
Un cantante de cumbia murió tras sufrir la picadura de una avispa en Entre Ríos
Osvaldo César Zaldivas era reconocido por ser el líder del grupo Cumbia Eterna. Producto de la alergia que le generó el veneno, sufrió un paro cardiorrespiratorio.


Se trata de productos que presentaron irregularidades por la falta de información sobre su procedencia.
Nacionales30 de septiembre de 2025 Prensa
Prensa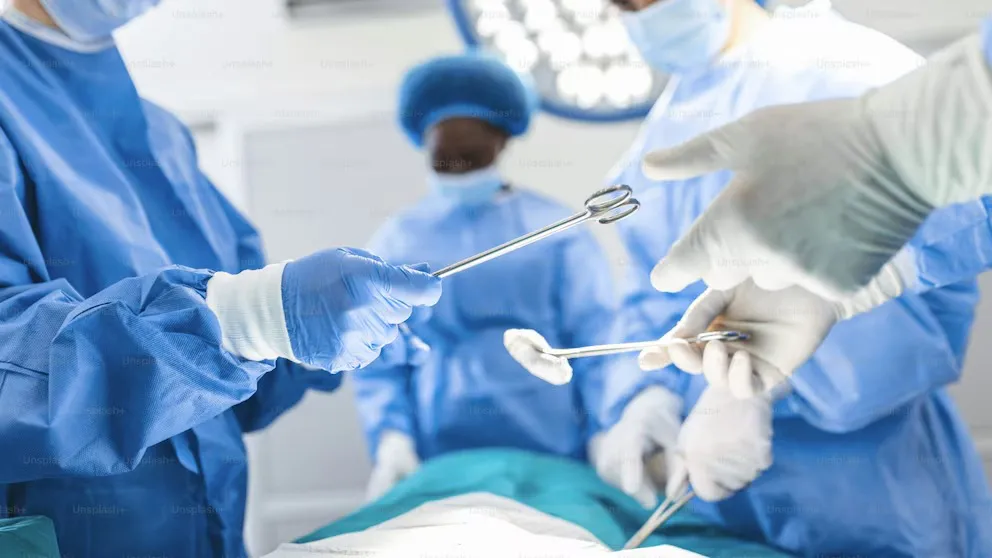
Debido a la sospecha de falsificación y falta de procedencia verificada, sobre dos productos utilizados para intervenciones quirúrgicas, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) dictó la prohibición de uso, comercialización y distribución de placas para osteosíntesis y puntas de shaver que eran ofrecidas en el mercado local.
La medida fue formalizada a través de la disposición 6670/2025 y afecta a productos identificados como “SM salud - Código E1999 - Material Elemento” y “Arthroscopic Shaver Blade STRYKER - REF 0375-552-000 - Fórmula Resector Cuer 5.0 mm x 125 mm - LOT 23222CE2”.
El procedimiento administrativo comenzó tras una inspección realizada en la sede de la firma “Soluciones Médicas”, ubicada en la Av. Santa Catalina al 3000, en la Ciudad de Posadas, Misiones. Allí, los inspectores de la ANMAT encontraron los productos médicos sin identificación sanitaria válida, entre ellos, una unidad de placas para osteosíntesis —un procedimiento empleado en traumatología que consiste en fijar y estabilizar huesos fracturados utilizando implantes metálicos, como placas, tornillos o clavos—, y una hoja de motor de artroscopia. Se trata de un instrumento descartable empleado en cirugías artroscópicas que permite cortar o retirar tejidos blandos, cartílago y hueso de forma precisa en el interior de una articulación.
Las piezas carecían de información sobre autorización sanitaria, fecha de vencimiento, incluso los datos del importador responsable. Además, la titular del establecimiento no pudo presentar documentos de adquisición, por lo que las unidades fueron retiradas para su análisis. “La inspeccionada informó que no contaba con documentación comercial de adquisición, por lo que se procedió a retirar las unidades en carácter de muestra para posterior verificación de legitimidad”, detalló el texto publicado en Boletín Oficial este martes.
Posteriormente, personal del Departamento de Control de Mercado de la Dirección de Evaluación y Gestión de Monitoreo de Productos para la Salud (DEYGMPS) inspeccionó la firma SM Salud S.R.L., autorizada como importadora y distribuidora interjurisdiccional de productos médicos. Ante la presentación del producto, la directora técnica de la empresa aclaró que esa unidad no había sido fabricada ni comercializada por su empresa. Detalló que las placas originales son de color gris y llevan grabado el logotipo, lote y código de referencia, mientras que la unidad examinada era celeste metalizado, sin ningún tipo de grabado ni etiquetas adecuadas.
Al avanzar en la investigación, el organismo también inspeccionó la sede de Stryker Corporation Sucursal Argentina, por tratarse de la responsable de importar legalmente dispositivos médicos de la marca Stryker. Por su parte, la responsable técnica confirmó que el lote “23222CE2”, “no ha sido importado por la firma, por lo que desconoce su estado de conservación y funcionalidad”.
El Departamento de Control de Mercado de la DEYGMPS concluyó que ambos productos infringían el artículo 19 de la Ley N° 16.463 y representaban un riesgo para la salud pública, ya que su origen era incierto y no podían garantizarse sus condiciones de fabricación y almacenamiento. Por tales motivos, y para prevenir posibles daños en pacientes o usuarios, se recomendó la prohibición absoluta del uso, comercialización y distribución de los dos productos.
A fin de proteger a eventuales adquirentes y usuarios de los productos ilegítimos mencionados, ANMAT dispuso además alertar a la población y a las autoridades sanitarias jurisdiccionales respecto a los riesgos de adquirir o utilizar estos productos, e instó a los profesionales y establecimientos médicos a revisar el origen y la legitimidad de los insumos para cirugías y tratamientos implantes.
Se ordenó, en consecuencia, informar a las autoridades provinciales, a las del Gobierno de la Ciudad Autónoma de Buenos Aires, a los organismos técnicos internos y a la Coordinación de Sumarios de la Administración para que adopten las acciones administrativas necesarias.

Osvaldo César Zaldivas era reconocido por ser el líder del grupo Cumbia Eterna. Producto de la alergia que le generó el veneno, sufrió un paro cardiorrespiratorio.

Una impactante explosión sacudió el Polo Industrial Spegazzini de Cañuelas. Varias dotaciones de bomberos trabajaron en el lugar. Se registraron heridos y daños materiales.





